2014與2015年台灣南部都爆發嚴重的登革熱(Dengue fever)疫情,但全世界每年有超過五億人感染登革熱!其中80%是無症狀或輕症,只有5%的病患會出現較嚴重的症狀。登革熱以數種黑斑蚊屬(Aedes)為病媒散播,原本只出現在東南亞,在二次世界大戰後變成遍佈全球的疾病。如今全世界有110個國家都有登革熱,每年造成一萬至兩萬人死亡。
一般來說,登革熱的死亡率低於1%,但如果是第二次感染或是嬰兒第一次感染,但媽媽曾感染登革熱,便有機會發展成出血性登革熱(Dengue Haemorrhagic Fever,DHF)。出血性登革熱患者會出現皮膚紅斑、臟器出血、伴隨著血小板低下等症狀。一旦發展成出血性登革熱,即使有治療,死亡率也會達到2-5%,若沒有治療則可高達50%,實在是非常危險。
一般來說,登革熱的死亡率低於1%,但如果是第二次感染或是嬰兒第一次感染,但媽媽曾感染登革熱,便有機會發展成出血性登革熱(Dengue Haemorrhagic Fever,DHF)。出血性登革熱患者會出現皮膚紅斑、臟器出血、伴隨著血小板低下等症狀。一旦發展成出血性登革熱,即使有治療,死亡率也會達到2-5%,若沒有治療則可高達50%,實在是非常危險。
近年來,由於全球暖化與人口移動頻繁,使得登革熱漸漸成為一種全球性的傳染病;雖然一般的登革熱症狀不嚴重、死亡率也低,但是出血性登革熱的威脅卻不可忽視。特別是登革熱輕症常被誤會成流感,若患者身體健康良好,很可能就自己去購買成藥服用,因此疫區內的人們,誰也不敢保證一旦罹患登革熱,究竟會不會就發展成出血性登革熱呢?
過去的研究知道,出血性登革熱是因為登革病毒感染會引發自體抗體(autoantibodies)的產生;這些抗體在體外的(in vitro)研究中發現,在登革病毒存在時,它們與病毒形成複合體,大量感染白血球,可能因此造成血管內皮細胞與血小板被大量的攻擊,造成血管損傷、血小板數目低下,最後造成皮下出血、臟器出血等病徵而死亡。
但是後續有許多研究發現,許多病毒在有抗體存在的狀況下都會有此現象。因此,究竟出血性登革熱是否真的是因為上述的現象而發生的呢?
但是後續有許多研究發現,許多病毒在有抗體存在的狀況下都會有此現象。因此,究竟出血性登革熱是否真的是因為上述的現象而發生的呢?
慈大生科院院長張新侯老師的研究團隊,花了好幾年的時間精益求精,建立了出血性登革熱的小鼠模型。為什麼要建立這個模型呢?由於出血性登革熱發生時,病人會因為血小板太少造成的內出血使得血壓急速降低而休克,產生所謂的登革熱休克症候群(DSS,Dengue Shock Syndrome)。DSS非常危險,若能提供動物模型作為治療的測試、從而建立有效治療的方法,便足以挽救上萬條生命!
不過,要發展一個理想的小鼠模型,實在不是一件容易的事。張老師的研究團隊,一開始嘗試著以靜脈注射的方式,分別將登革病毒與登革病毒所誘發的自體抗體各自打入小鼠。小鼠不但沒死,而且解剖時也發現,小鼠的臟器只有紅腫,沒有出血。
不過,要發展一個理想的小鼠模型,實在不是一件容易的事。張老師的研究團隊,一開始嘗試著以靜脈注射的方式,分別將登革病毒與登革病毒所誘發的自體抗體各自打入小鼠。小鼠不但沒死,而且解剖時也發現,小鼠的臟器只有紅腫,沒有出血。
這令人有點傷心,雖然小鼠不是人,或許因此症狀有不同;但沒能夠呈現與人一樣的症狀,的確是不夠完美。究竟要怎麼改善,才能夠建立一個十全十美的小鼠模型呢?
張老師苦苦地思索著,卻想不出改善的空間在哪裡?直到有一天無意中看到了施瓦茨曼反應(Shwartzman)的文獻。
1920年代,在紐約西奈山醫院工作的喬治‧施瓦茨曼醫師(Dr. George Shwartzman)在研究某些毒素如何在組織中產生血栓時,發現了這個現象。簡單來說,施瓦茨曼醫師發現,當我們的組織再次接觸到同一個毒素時,便會有這樣的現象發生。而要產生施瓦茨曼反應,病患要跟相同的毒素接觸兩次。但是,在施瓦茨曼反應裡,毒素是以皮下注射,而不是以靜脈注射的方式。
皮下注射?張老師忽然想到,或許皮下注射才是對的!
於是,張老師便趕緊將病毒改為皮下注射方式打入小鼠。結果真是令人喜出望外!果然出現了臟器出血的病徵!完美的出血性登革熱的模式有了!
模式有了,接著就有得忙了!再接再厲地以這個模式進行研究時也發現了,出血性登革熱需要在登革熱病毒與自體抗體同時存在的狀況下才會出現,缺一不可。但是,病毒與抗體究竟誰要先出現,並沒有絕對的關係。
怎麼說呢?以嬰兒出血性登革熱為例,小寶寶是先由媽媽得到登革熱的自體抗體後,再接觸到病毒。而成人在第二次感染時所發展出來的出血性登革熱,則是先有病毒再有抗體。
張老師的研究團隊也進一步在小鼠中證明,當以出血性登革熱病人血中登革病毒效價與非致病濃度之自體抗體同時存在於宿主體內時的確會造成血管損傷與臟器出血!這是第一次在活體中(in vivo)明顯到觀察到這樣的現象。過去其他研究團隊都只能以高量的病毒來重現出血性登革熱的症狀,但是在活體內要有這樣高濃度的病毒很難啊!可是這次張老師的研究團隊卻是以較低濃度就達成了!
張老師的研究團隊,除了建立小鼠的出血性登革熱模型之外,他們同時也以數種目前已經有在使用的藥物,如:腫瘤壞死因子α(TNFα)的拮抗劑Etanercept等,針對這個模型進行試驗,發現這些藥物如果在適當的時機下使用,對於出血性登革熱是有治療效果的;同時也對於出血性登革熱的致病機轉有更多的了解。
 |
| 圖片來源:Thrombosis and Haemostasis |
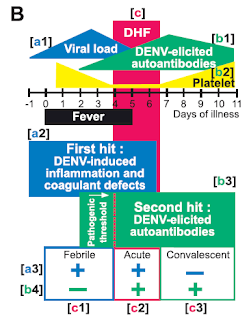
張老師的團隊在建立小鼠模型的過程中,也發現出血性登革熱存在著一個「治療黃金期」。如上圖所示,當病毒進入宿主體內後,病毒的濃度大約在發病(發燒)前一天開始上昇(viral load,藍色三角形);而自體抗體則在發燒後兩天開始出現(DENV-elicited autoantibodies,綠色三角形)。在這段期間,病毒的濃度持續升高,直到自體抗體出現後,病毒濃度開始下降。下降後大約24-36小時,出血性登革熱(DHF,紅色)的症狀就出現了。
治療黃金期在哪裡呢?就是當病毒濃度在體內達到高峰並開始下降、體內的自體抗體卻逐漸上昇的時候。研究團隊利用這個小鼠模型,測試了幾種藥物(如Etanercept、IVIg)都有不錯的療效,但因為它們都屬於免疫抑制劑,若使用於發病初期,只怕會對病人有不好的影響;但如能用在病毒濃度開始下降、自體抗體濃度上昇,但出血的症狀尚未出現的時候,對於出血性登革熱的治療應該會有相當好的效果。
治療黃金期在哪裡呢?就是當病毒濃度在體內達到高峰並開始下降、體內的自體抗體卻逐漸上昇的時候。研究團隊利用這個小鼠模型,測試了幾種藥物(如Etanercept、IVIg)都有不錯的療效,但因為它們都屬於免疫抑制劑,若使用於發病初期,只怕會對病人有不好的影響;但如能用在病毒濃度開始下降、自體抗體濃度上昇,但出血的症狀尚未出現的時候,對於出血性登革熱的治療應該會有相當好的效果。
參考文獻:
Te-Sheng Lien et. al. 2015. Dengue virus and antiplatelet autoantibodies synergistically induce
haemorrhage through Nlrp3-inflammasome and FcγIII. Thrombosis and Haemostasis. http://dx.doi.org/10.1160/TH14-07-0637. 113: 1060–1070

沒有留言:
張貼留言